
Zleva: MUDr. Jana Vančurová, prim. MUDr. Petr Vaník, Ph.D., zdravotní sestra Kamila Gruberová a prim. MUDr. Jiří Krbec
Pneumoonkochirurgický multidisciplinární tým (MDT) se schází každé úterý v 10.30 hodin ve čtvrtém patře pavilonu C. Současnými členy pneumoonkochirurgického týmu jsou prim. MUDr. Petr Vaník, Ph.D., MUDr. Hana Šuldová, MUDr. Jana Vančurová, MUDr. Jan Capouch, prim. MUDr. Jiří Krbec, doc. MUDr. Vojtěch Kurfirst, Ph.D., a MUDr. Júlia Tájková Csanády. Dalšími úzce a nezbytně spolupracujícími specialisty jsou patolog a radiodiagnostik.
Spolupráce těchto ale i dalších odborností trvá historicky dlouhá desetiletí. Pouze největší pamětníci jako em. prim. MUDr. Václav Šnorek pamatují, když prim. MUDr. Vladimír Tvarůžek ustanovil první (a právě plicní) onkotým v Nemocnici České Budějovice, a.s. Z dalších pneumologů je třeba zmínit prim. MUDr. Jana Zavadila, prim. MUDr. Václava Šnorka, MUDr. Lenku Kozlerovou, MUDr. Zdeňka Ryanta. Za onkology se MDT dlouhodobě účastnili prim. MUDr. Jan Fischer, MUDr. Hana Šiffnerová, Ph.D, za chirurgy pak prim. MUDr. Bohuslav Cypro, CSc., MUDr. Adolf Drs a doc. MUDr. Vladislav Hytych, Ph.D. Nelze rovněž nezmínit dlouholetou vynikající spolupráci s prim. MUDr. Janou Přádnou z Patologického oddělení. Smyslem práce pneumoonkochirurgického MDT při Komplexním onkologickém centru Nemocnice České Budějovice, a.s., je v rámci regionu posoudit a správně vyhodnotit, eventuálně doplnit, nezbytná vyšetření referovaných pacientů s plicními onkologickými onemocněními a stanovit a načasovat nejvhodnější způsob léčby s ohledem na věk, celkový výkonnostní stav a přidružená onemocnění daného konkrétního pacienta, jakož i s ohledem na respektování jeho vůle.
Pro správné nastavení léčebného postupu a jeho modalit jsou nezbytná stagingová vyšetření, která odhalí rozsah onemocnění, provedená spolupracujícími regionálními pneumologickými a onkologickými nemocničními i ambulantními pracovišti. Za nezbytné považujeme v MDT fyzické posouzení všech provedených zobrazovacích vyšetření (CT, PET-CT, MR, UZ) stejně jako fyzickou přítomnost pacienta.
Je-li MDT stanovena operační léčba plicního onkologického onemocnění a je-li jí pacient ochoten a schopen podstoupit, což závisí na jeho celkovém stavu a funkční kapacitě plic, máme v současné době zpravidla několik způsobů jejího provedení.
Z invazivních operačních přístupů – torakotomie (otevřený přístup mezižebřím do pohrudniční dutiny), sternotomie (otevřený přístup přes prsní kost, mediastinotomie (otevřený přístup do mezihrudí) – jsou prováděny rozsáhlejší plicní Představujeme Pneumoonkochirurgický multidisciplinární tým Nemocnice České Budějovice anatomické i neanatomické resekce (operační odstranění) včetně resekcí rozšířených, resekcí hrudní stěny či vybraných nádorů mezihrudí.
Z miniinvazivních operačních výkonů, mezi které patří videotorakoskopie (VTS) - operační řešení z několika malých vstupních portů za pomoci miniinvazivního torakoskopického instrumentaria a se zobrazením operačního pole na monitoru a videomediastinoskopie a videoasistovaná torakoskopie (VATS) - navíc již kombinace torakoskopického ale i vybraného otevřeného instrumentaria. Ve 2D i 3D modu pak resekujeme dostupné plicní nádory, nádory mezihrudí, uzliny mezihrudí, provádíme cílené chirurgické odběry plicní tkáně, chirurgické ošetření pohrudnice.
Poslední nově zavedenou miniinvazivní metodou jsou roboticky asistované torakochirurgické výkony (RATS). Tato metoda umožňuje provádět podobné spektrum výkonů jako metoda VATS za použití robotického systému Da Vinci X. V současné době jde o nejmodernější postup v chirurgické léčbě vybraných plicních nádorů.
Je plně na rozhodnutí, zkušenostech a zodpovědnosti hrudního chirurga a anesteziologa stanovit pro pacienta ten nejbezpečnější způsob chirurgického ošetření, přičemž je třeba přihlédnout ke všem okolnostem a cílem je vždy co nejlepší pooperační výsledek při nejnižší možné morbiditě a mortalitě.
Po provedeném operačním výkonu je pacient znovu s nezbytným rekonvalescenčním odstupem (zpravidla již ambulantně) konzultován v MDT s výsledky všech histopatologických, imunohistochemických, ev. molekulárněgenetických vyšetření chirurgicky odstraněných patologických tkání a orgánů a je týmově stanoven další léčebný postup či plán dalšího pravidelného sledování.
prim. MUDr. Jiří Krbec, Oddělení kardiochirurgie, hrudní chirurgie a cévní chirurgie
Úlohou pneumologa je ve spolupráci s lékaři dalších oddělení, především Radiologického oddělení, Patologického oddělení a Oddělení kardiochirurgie, hrudní chirurgie a cévní chirurgie, kompletní diagnostika plicních nádorů.
Diagnostika
Základní vyšetřovací metodou je u každého nemocného s podezřením na plicní nádor CT vyšetření a bronchoskopie. Na našem oddělení provádíme bronchoskopie v celkové nebo lokální anestezii na nově vybaveném bronchoskopickém sále. Při tomto vyšetření odebíráme vzorky k histologickému (větší kus tkáně) nebo cytologickému (jednotlivé buňky na sklíčku) stanovení diagnózy.
Cytologicky vyšetřujeme vzorky sami a v některých případech jsme schopni v krátké době určit, zda se jedná o zhoubný nádor i jaké je jeho bližší určení. Vyšetření histologické provádí Patologické oddělení. V některých případech je ovšem k definitivnímu určení diagnózy nutný i zákrok hrudních chirurgů.
Po zjištění diagnózy je dalším krokem stanovení rozsahu onemocnění (staging). K tomu nám napomáhají CT spolu s ultrazvukem břicha nebo, v optimálním případě, PET/CT vyšetření, přičemž při neurologických symptomech pacienta doplňujeme CT mozku a v některých případech i izotopové vyšetření kostí na Oddělení nukleární medicíny.
Bronchologie
Každým rokem provádíme kolem 700 bronchoskopických vyšetření. Odhadem čtvrtina všech výkonů je pro podezření na nádorové onemocnění plic. Bronchoskopie stále představuje nejdůležitější diagnostické vyšetření s odběrem vzorků k určení histologického typu plicního nádoru. Diagnostika je odlišná u centrálně uložených a u periferních plicních tumorů. V oblasti diagnostiky solitárních periferních plicních ložisek (drobných samostatných nádorů v plíci) je v současné době nejužívanější kombinace bronchoskopie pod skiaskopickou (RTG) kontrolou a následné potvrzení správného místa odběru vzorku pomocí radiálního ultrazvuku (rEBUS), což je rotující sonda na konci vodicího drátu, kterou můžeme sondovat jednotlivé periferní průdušky. Při skiaskopii pod RTG kontrolou zavedeme vodicí sondu do oblasti periferního ložiska, poté tuto sondu zafixujeme, pomocí rEBUS zkontrolujeme, zda jsme skutečně v oblasti patologického ložiska, a následně přes kanál sondy kleštěmi odebíráme vzorky na histologii a kartáčkem na cytologii. Výtěžnost je velmi ovlivněna umístěním ložiska, jeho velikostí a tím, zda směrem k ložisku vedou periferní průdušky. I přes precizní provedení výkonu je výtěžnost u nodulů (drobných nádorů) o velikosti do dvou centimetrů jen kolem 33 %, u větších ložisek pak kolem 65–70 %.
Pokud jsou periferní ložiska při hrudní stěně, v diagnostice nám významně pomáhají radiologové, a to provedením transthorakální punkce ložiska (punkce ložiska jehlou přes hrudní stěnu) pod CT kontrolou – výtěžnost tohoto vyšetření je velmi dobrá a riziko komplikací malé.
V současné době jsou na trhu k dispozici softwarové navigační systémy nové generace (Lung Vision, Archimedes, Illumisite), jejichž většímu rozšíření do praxe brání vysoká pořizovací cena, jakož i přetrvávající vysoká cena jednorázových sond.
V případech nediagnostikovaných nálezů další postup konzultujeme s hrudními chirurgy, s kterými máme dlouhodobě vynikající spolupráci. Problémy nastávají u pacientů, u nichž jejich špatné plicní funkce při spirometrii (funkčním vyšetření plic) nebo závažné přidružené nemoci neumožňují jakýkoli zásah chirurga. Jednotlivé případy pak řešíme individuálně; někdy je naší jedinou možností tyto pacienty už jen sledovat a v případě progrese nálezu pak zkusit zopakovat diagnostickou bronchoskopii, pokud to stav pacienta umožní.
Vcelku snadná je diagnostika endobronchiálních nálezů (viditelných ve velkých dechových cestách) u centrálních tumorů. V posledních letech jich však z nejasných příčin postupně ubývá a naopak přibývá periferních plicích tumorů. Pokud jsou centrální nálezy mimo dechové cesty, ale v jejich blízkosti, v diagnostice nám významně pomáhá užití lineárního ultrazvukového vyšetření (ultrazvuk na konci ohebného bronchoskopu) uvnitř průdušek (EBUS). EBUS se pro diagnostiku v bronchologii významněji používá již přes dvacet let. Diagnózy plicního karcinomu dosahujeme punkcí lymfatických uzlin při velkých dechových cestách přes stěnu průdušek za přímé vizuální kontroly ultrazvukem, přičemž tak současně upřesňujeme staging onemocnění. V mnoha případech menších nádorů mimo hlavní dechové cesty byl materiál z lymfatické uzliny jediným diagnostickým materiálem a současně jsme mnoho pacientů ušetřili nutnosti podstoupit diagnostický chirurgický zákrok, který přináší vyšší riziko komplikací. Punkce pod ultrazvukem je oproti tomu bezpečné vyšetření, u nějž se komplikace prakticky nevyskytují, zatímco výtěžnost vyšetření je velmi vysoká.
Na našem oddělení jsme touto technikou začali vyšetřovat počátkem roku 2007 (po předchozí stáži na klinice v Heidelbergu, což je velmi pravděpodobně nejlepší bronchologické pracoviště na světě). Je třeba poznamenat, že doba potřebná k seznámení a naučení metody je dlouhá, a to i kvůli relativně omezenému množství výkonů v určitém časovém období – dlouhodobě těchto punkcí provádíme přibližně sto za rok.
prim. MUDr. Petr Vaník, Ph.D. Oddělení plicní a TBC
Nádory plic představují třetí nejčastější nádorové onemocnění jak u mužů, tak i u žen, ale vzhledem k jejich vysoké mortalitě jsou současně nejčastější příčinou úmrtí na nádorová onemocnění ve světě.
Téměř 70 % pacientů je diagnostikováno až v pokročilé fázi onemocnění (stadium III a IV), což souvisí s nepříznivou prognózou tohoto onemocnění. Přežití pacientů s karcinomem plic se však díky novým léčebným metodám postupně zlepšuje, v současné době 5 let od diagnózy onemocnění přežívá 20 % pacientů.
Karcinom plic dělíme dle histologie na dva základní podtypy: malobuněčný karcinom a skupinu nemalobuněčných karcinomů, z nichž nejčastější jsou adenokarcinom a dlaždicobuněčný karcinom. Často se setkáváme i s plicními metastázami jiných primárních tumorů.
Vznik karcinomu plic je ve vysoké míře spojen s kouřením. Pacienti s touto diagnózou mají často vícečetné komorbidity a v důsledku onemocnění zhoršený celkový stav, navíc výrazně ubývají na váze – jde o skutečnosti, které omezují léčebné možnosti. Méně často se setkáváme s nádory plic u nekuřáků, kde onemocnění vzniká oproti kuřákům jiným mechanismem, což nám umožňuje častější použití cílené léčby. Volba léčebného postupu se řídí rozsahem onemocnění, histologií a výsledky genetického vyšetření nádorových buněk, celkovým stavem pacienta, přidruženými chorobami a přáním pacienta.
U časných stadií nemalobuněčného karcinomu je preferován chirurgický zákrok, dle pooperační histologie můžeme doporučit zajišťovací onkologickou léčbu, jejímž cílem je snížit riziko návratu onemocnění. Pokud pacient není únosný k operaci, indikujeme radioterapii. U pokročilejších stadií využíváme kombinace systémové léčby, radioterapie a chirurgie.
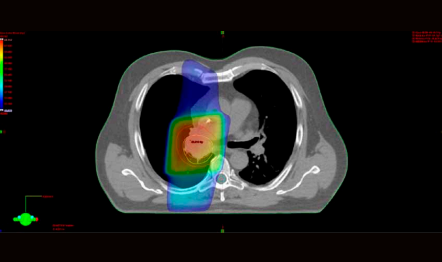
Rozložení dávky při ozařování konformní T technikou
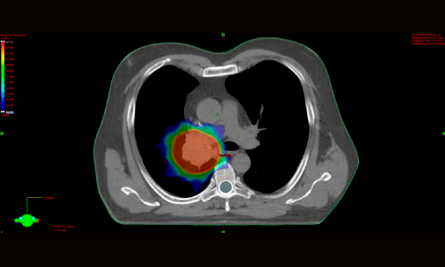
Rozložení dávky při ozařování IMRT technikou
U onemocnění se vzdálenými metastázami volíme dle stavu a obtíží pacienta paliativní systémovou léčbu či paliativní radioterapii, u pacientů v celkově špatném stavu a s velkým váhovým úbytkem symptomatickou léčbu.
Výsledky léčby u malobuněčného karcinomu jsou vzhledem k jeho rychlému růstu a časnému metastázování neuspokojivé. U limitovaného stadia onemocnění (bez vzdálených metastáz) je standardem léčby kombinace chemoterapie a radioterapie, u pokročilejších stadií indikujeme v závislosti na stavu pacienta systémovou léčbu, paliativní radioterapii nebo jen symptomatickou léčbu.
Dlouhá léta jsme v rámci onkologické léčby měli k dispozici pouze ozařování a chemoterapii. Během posledních patnácti až dvaceti let se však naše léčebné možnosti výrazně rozšířily, a to díky zavedení cílené léčby a imunoterapie.
U pacientů s prokázanými genetickými změnami v nádorové buňce (mutace EGFR, ALK, ROS1 a další) lze podáním cíleného inhibitoru docílit významné odpovědi na léčbu a několikanásobnému zlepšení mediánu přežití.
Cílem imunoterapie je podpořit vlastní imunitní systém pacienta v boji s rakovinou. Výhodou této léčby je, že navozená imunitní reakce pokračuje i po jejím ukončení. U pokročilých onemocnění můžeme imunoterapii kombinovat s chemoterapií, u některých pacientů ji lze podat i samostatně, využívá se i v léčbě lokalizovaného onemocnění po kurativní chemoradioterapii nebo po radikální operaci, nově i v předoperační léčbě.
I v oblasti radioterapie došlo k rozšíření našich možností. Pacienty s primárními nádory nebo metastázami do 5 cm odesíláme ke stereotaktickému ozáření Cyberknifem na spolupracující pracoviště do FN Ostrava nebo ÚVN Praha, u pokročilejších nádorů využíváme ozařování s modulovanou intenzitou svazku (IMRT) a ozařování v hlubokém nádechu (DIBH), které nám do nádorového ložiska umožňují dodat vyšší dávku a zároveň šetřit okolní zdravé tkáně.
I přes pokroky v diagnostice a léčbě představuje karcinom plic závažné a život ohrožující onemocnění, které pacientovi přináší řadu obtíží a zhoršení kvality života. U nemalé části pacientů v týmu navíc doporučíme pouze symptomatickou péči. Pro nás i naše pacienty je proto důležitá i spolupráce s paliativní ambulancí naší nemocnice.
MUDr. Jana Vančurová, Onkologické oddělení
Patolog hraje v diagnostickoterapeutickém procesu nádorových onemocnění plic důležitou roli. Pokud jde o onkologická onemocnění, právě nádory plic jsou celosvětově nejčastější příčinou úmrtí. Největším rizikovým faktorem jejich vzniku je kouření. Velká část těchto nádorů je však stále diagnostikována až v pokročilém klinickém stadiu. Proto se kromě zavedení preventivního screeningového programu záchytu rakoviny plic u rizikové populace klade důraz hlavně na přesnou a včasnou diagnostiku jednotlivých subtypů plicních nádorů. Cílem těchto úkonů je prodloužení a zachování co možná nejlepší kvality pacientova života, snížení mortality (úmrtnosti) a morbidity (nemocnosti).
Nejčastější nádory plic lze zjednodušeně rozdělit do dvou základních skupin, a to na malobuněčné karcinomy a nemalobuněčné plicní karcinomy (tzv. non-small cell lung carcinoma, NSCLC). Malobuněčný karcinom je vysoce agresivní nádor vyskytující se v přibližně 10–15% nádorů plic a je téměř výlučně spojován s kouřením. Ve většině případů je diagnostikován v pozdním stadiu s již přítomnými vzdálenými metastázami.
Nemalobuněčné plicní karcinomy tvoří asi 80–85 % nádorů plic a skládají se z mnoha jednotek. V základu se dělí na dlaždicobuněčné (skvamózní) karcinomy a tzv. neskvamózní NSCLC. Do této skupiny patří nejčastěji se vyskytující adenokarcinom, nemalobuněčný karcinom blíže nespecifikovaný (NSCLC, not otherwise specified), velkobuněčný karcinom (large cell carcinoma, LCC) a méně častý adenoskvamózní a mukoepidermoidní karcinom.
Hlavní úlohou patologa je přesně a rychle (v řádech několika málo dní) definovat, o který typ nádoru se jedná, a to dle platných nomenklaturních pravidel a doporučení Světové zdravotnické organizace (World Health Organization, WHO). Patolog zhodnotí diferenciaci nádoru včetně dalších prognostických ukazatelů, jako je lokalizace nádoru, jeho velikost, postižení poplicnice a resekčních okrajů, propagace nádoru podél větví periferních nervů, proniknutí nádoru do krevních a lymfatických cév a přítomnost metastáz ve spádových či vzdálených lymfatických uzlinách a orgánech. Součástí každého nálezu je stanovení patologického stadia dle TNM klasifikace zhoubných novotvarů. K diagnostice jednotlivých typů nádorů je často nutné využít různých kombinací imunohistochemických protilátek. Ty detekují specifické antigeny na membráně, v cytoplazmě či v jádře nádorových buněk.
Kromě přesné diagnostiky je téměř u každého výše zmíněného nádoru potřeba, aby patolog dovyšetřil soubor tzv. prediktivních markerů. Jedná se o testování velké řady geneticky podmíněných znaků nádoru, které zodpovídají za jeho vznik. Výsledek pomůže předpovědět, zda zvolená terapie bude spíše účinná, či nikoliv. V dnešní době dochází v rámci personalizované medicíny k velmi progresivnímu vývoji nových léčebných modalit, jež specificky cílí na tyto nádorové změny. Patologovo vyšetření prediktivních markerů je tak pro kolegy onkology naprosto klíčové ve volbě vhodné terapie.
V době stanovení diagnózy patolog u všech NSCLC reflexně vyšetří expresi markeru PD-L1 na nádorových buňkách (programed cell death ligand 1, znak blokující programovanou buněčnou smrt nádorových buněk). U neskvamózních NSCLC se kromě markeru PD-L1 vyšetřují i další znaky – ALK (anaplastic lymphoma kinase) a ROS1 (proto-oncogene tyrosine-protein kinas-1). V rámci úzké a každodenní spolupráce patologa a molekulárního genetika z Laboratoře molekulární biologie a genetiky poté dojde k dovyšetření dalších nejčastěji se vyskytujících genetických změn nádoru, zejména v genech EGFR, KRAS, BRAF, HER2, RET, MET a NTRK. Pokud je výsledek všech těchto vyšetření negativní, lze po konzultaci nálezu s onkologem přistoupit ke komplexnímu testování kompletního panelu pro plicní nádory sestaveného odbornými společnostmi, který čítá téměř 30 genů. Jelikož se spektrum molekulárně geneticky definovaných prediktivních markerů s rozvojem cílené léčby neustále rozšiřuje, využívají se pro jejich detekci moderní metody, jako je tzv. masivní paralelní sekvenování (NGS – sekvenování nové generace). S tím narůstají i nároky na kvantitu a kvalitu vyšetřovaného materiálu s pevně stanovenými nepodkročitelnými minimy.
Pro vyšetření exprese prediktoru PD-L1 je potřeba alespoň 100 vitálních (vhodně zachovalých) nádorových buněk ve vzorku. Pro molekulárně genetické vyšetření je nutné, aby ve vzorku bylo přítomno alespoň 300 vitálních nádorových buněk nebo aby objem nádorové tkáně ve vzorku činil alespoň 10, ideálně však 20–30%. Vzorky, které jsou starší než pět let, mohou být problematické, jelikož nádorová DNA stárne, a výsledek vyšetření je tak zatížen možnou falešnou negativitou.
Veškeré výsledky jsou následně distribuovány členům plicního onkotýmu a pomáhají jim ve volbě vhodné terapie.
Úzká multidisciplinární spolupráce všech odborností podílejících se na trendu personalizované medicíny je tedy absolutní nezbytností.
MUDr. Petra Hroudová, Patologické oddělení